“Esto es una completa $%$%#, lo que nos estás diciendo aquí es una completa $%#$$#”.
Ingmar Hoerr había presentado resultados preliminares acerca del uso del ARNm como candidato vacunal en modelo de ratón y, sin embargo, en aquella conferencia un ganador de Premio Nobel consideraba no más que patrañas, los hallazgos de uno de los fundadores de CureVac. Hasta la fecha, Hoerr guarda para sí, el nombre de aquel investigador.
Con el paso de los años y la entrada de financiamiento, la idea de CureVac de escalar la experimentación a pruebas en humanos se volvió una realidad. Al más puro estilo de Jonas Salk (el pionero en la vacuna contra la polio), Steve Pascolo, quien en esa época se desempeñaba como Director Científico de la empresa, se convirtió en el primer sujeto de prueba de la investigación que se estaba desarrollando. Dieciséis horas después de haber sido inoculado en la pierna con ARN mensajero (ARNm) que llevaba la secuencia para sintetizar la enzima luciferasa, una biopsia de tejido confirmó que las células humanas también son capaces de captar el ARNm exógeno y convertirlo en una proteína.
“Nuestros resultados abren el camino hacia el uso del ARNm como vehículo para la terapia de genes en humanos”
destacaba el reporte de resultados publicado en Gene Therapy aquel mayo del 2007.
Como si los astros (o, más ad hoc, las bases nitrogenadas) se hubieran alineado, el año 2007 no solo marcó un parteaguas para Pascolo y Hoerr. Uğur Şahin y su esposa Ozlem Türeci de la compañia BioNtech, recibieron de un grupo de inversionistas, financiación por 150 millones de euros después presentar un plan comercial fundamentado en los estudios sobre el ARNm que habían comenzado a finales de la década de los 90s. Además, la empresa ARNRx, fundada por la bioquímica Katalin Karikó y el inmunólogo Drew Weissman, recibió una subvención para pequeñas empresas por parte del gobierno de Estados Unidos. 97,396 dólares estaban a punto de potenciar la idea en la cual Karikó trabajó durante toda la década de 1990. Con una modificación que permitía sobrepasar la barrera del sistema inmune innato de la célula, el ARNm estaba a punto de transformarse en una plataforma de relevancia terapéutica; la clave estaba en una de las bases de la molécula.
Cuando en 1997 Karikó comenzó a trabajar con Weissman en UPenn (Pensilvania), el objetivo principal era desarrollar una vacuna contra VIH/SIDA basada en el uso del ARNm, pero a pesar de haber realizado modificaciones al protocolo de Malone que permitían incrementar la eficiencia de transfección, el ARNm de Weismman y Karikó continuaba desencadenando una respuesta inflamatoria exacerbada cuando era inoculado en ratones. Al parecer, el ARNm sintético que utilizaban los investigadores era detectado por receptores de tipo Toll (TLR´s, por sus siglas en inglés), sensores del sistema inmune encargados de responder ante las infecciones por patógenos, los cuales identificaban al ARNm sintético como una amenaza.
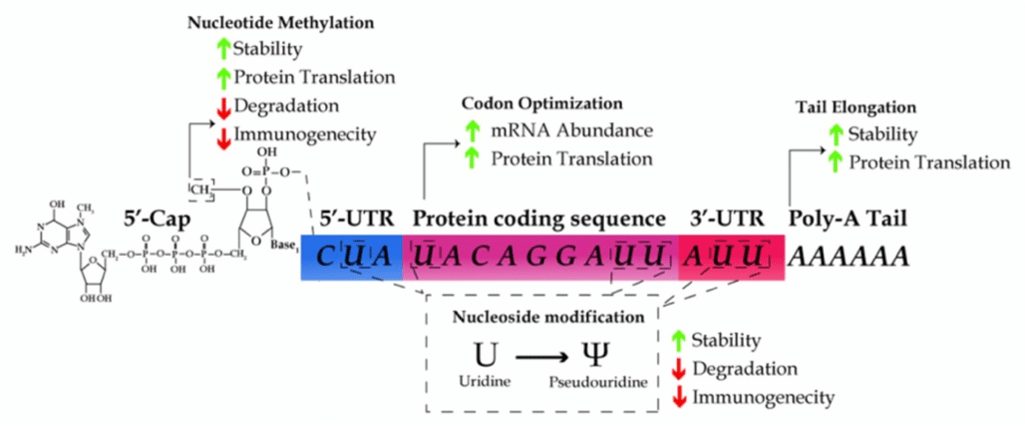
Habiendo identificado que el ARN puede ser reconocido por los receptores de célula, Karikó y Weismman realizaron experimentos incorporando diferentes modificaciones en la molécula de ARN, entre las cuales se encontraba la incorporación de pseudouridina en la estructura (Figura 1). Las células dendríticas expuestas al ARN modificado producían una respuesta inflamatoria considerablemente menor y el hallazgo no pasó desapercibido.
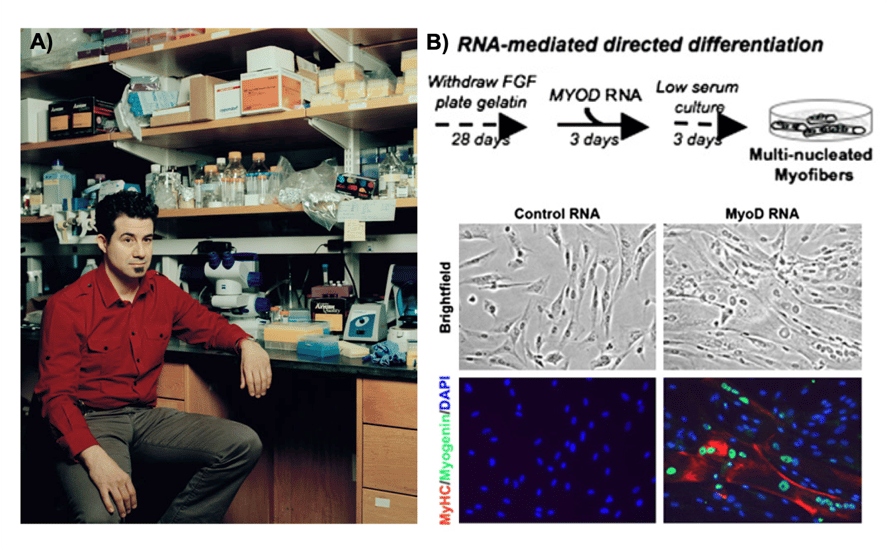
En septiembre del 2010, un grupo liderado por Derrick Rossi del Hospital de Niños en Boston, Massachusetts, demostró que el ARN modificado podía ser utilizado para generar células madre pluripotentes inducidas (iPSCs) con una eficiencia superior a la obtenida por los protocolos hasta ese momento establecidos e inclusive, lograron dirigir la diferenciación de IPSCs a células de músculo. El siguiente año, Rossi apareció en la revista Time como uno de los personajes más influyentes del 2010 y se convirtió en el cofundador de la compañía Moderna, con sede en Cambridge (Figura 2). Para inicios del 2020, Moderna contaba con 9 candidatos vacunales basados en la tecnología del mRNA; la mayoría se encontraba en alguna fase de las pruebas necesarias para su aplicación en humanos.
El 30 de enero del 2020, la OMS clasificó a la entonces epidemia por COVID19, como una emergencia de salud pública de preocupación internacional y, ante el aumento en el número de contagios y muertes así como la diseminación del virus SARS-CoV-2 a diferentes países, el 11 de marzo adquirió estatus de pandemia. “Nunca antes habíamos visto una pandemia provocada por un coronavirus. Y nunca antes hemos visto una pandemia que pueda ser controlada al mismo tiempo” mencionaba a los medios de comunicación el director de la OMS, pero la molécula que en un inicio había sido considerada inestable y poco prometedora, estaba a punto de cambiar el rumbo de la pandemia.
A pocos días de haber sido liberada la secuencia de SARS-COV-2, Moderna creó un prototipo de vacuna y colaboró con el Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos (NIAID) para evaluar tanto su seguridad como efectividad, en modelo de ratón y posteriormente, en pocas semanas, escalar las pruebas a humanos. Por su parte, BioNTech se asoció con la farmacéutica Pfizer y utilizando su prototipo vacunal, en menos de 10 meses lograron llevar a cabo los primeros ensayos en humanos y la aprobación de emergencia de BNT16b2. De acuerdo con un reporte de Abril 2022, tan solo el activo de Pfizer-Biontech contribuyó de manera importante en la prevención de millones de casos sintomáticos graves y miles de hospitalizaciones y muertes en Estados Unidos durante el primer año después de su aprobación.
A la fecha, la modificación del ARNm como característica esencial para la eficiencia de las vacunas basadas en esta plataforma continúa en debate. Investigadores de empresas importantes como Takeda, Sanofi y CureVac han propuesto como alternativas al uso de ARN modificado el uso de diferentes estructuras “cap”, la remoción de impurezas para incrementar la calidad del ARN y minimizar la cantidad de uridinas en sus candidatos vacunales, sin embargo, algunos de los candidatos vacunales continúan en las primeras fases de ensayos en humanos o ya se ha demostrado que la efectividad es menor en relación a las vacunas de Moderna y Pfizer-BioNtech. Con base en estos resultados, algunos investigadores han considerado como esencial, la incorporación de la pseudouridina. “El verdadero ganador aquí es el ARNm modificado”, mencionó en algún momento Jake Becraft, co fundador y jefe ejecutivo de Stran Therapeutics.
¿Quieres saber más?
Karikó, K., et al. (2005), “Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA“, Immunity, 23 (2): 165-175.
Karikó, K., et al. (1998), “Phosphate-enhanced transfection of cationic lipid-complexed mRNA and plasmid DNA“, Biochim Biophys Acta, 1369 (2): 320-334.
Probst, et al. (2007), “Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent“, Gene Therapy, 14: 1175-1180.