El 1 de marzo es el aniversario oficial de la tabla periódica, establecido por la Unión Internacional de Química Pura y Aplicada (IUPAC), por lo que he decidido escribir esta entrada. Antes de seguir leyendo, tómate unos segundos para apreciar la distribución de los elementos químicos en la tabla (Figura 1).
La organización de la tabla periódica nos puede resultar muy familiar, pero ¿alguna vez te preguntaste por qué está ordenada de esta manera y no de otra? Si tú fueras el encargado de ordenar los elementos químicos que conforman todo el Universo, ¿cómo lo harías? ¿Lo harías por orden alfabético? ¿Año de descubrimiento? ¿Color? … ¿O por el peso de cada uno de ellos?
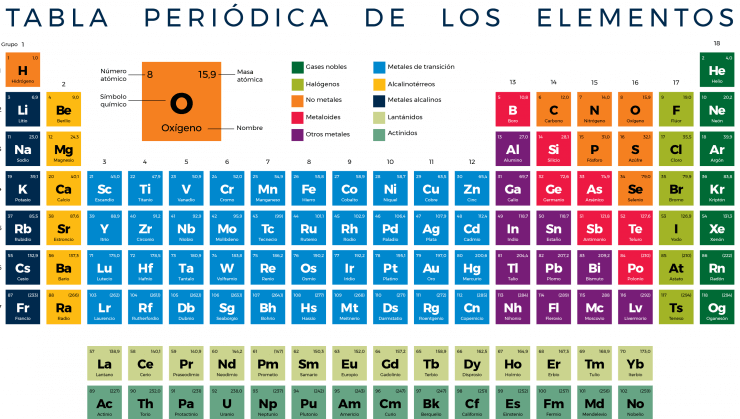
Actualmente podemos responder fácilmente esta pregunta, pero a mediados del siglo XIX solo se conocían 63 elementos químicos y existía una enorme incertidumbre sobre el número de nuevos elementos por descubrir. Entonces, ¿cómo se creó la tabla periódica de los elementos? Un hecho destacable en este camino, fue el establecimiento del concepto de peso atómico realizado por Stanislao Cannizzaro. Recordemos que el peso atómico es la masa promedio de todos los isótopos de un elemento en la naturaleza, mientras que la masa atómica es la masa total de protones y neutrones en un átomo o isótopo particular.
A partir del peso atómico, el 17 de febrero de 1869, el químico ruso Dimitri Ivanovich Mendeleyev propuso ordenar los 63 elementos químicos conocidos hasta el momento de acuerdo con su peso atómico. Pero su aportación no terminó allí. Mendeleyev dejó espacios para los elementos no descubiertos; con ello, predijo el descubrimiento de nuevos elementos químicos con diferente masa atómica. Además, ordenar a los elementos de esta manera permitió el descubrimiento de las propiedades periódicas de los elementos, por ejemplo, la electronegatividad, la afinidad electrónica, el potencial de ionización, la densidad atómica y el volumen atómico.
La tabla periódica fue adquiriendo poco a poco la apariencia que tiene hoy en día. Una última modificación a la tabla periódica de Mendeleyev la realizó Henry Moseley en 1913. La aportación de Moseley consistió en establecer el orden de los elementos químicos en función de su número atómico, es decir, el número de protones en el núcleo del átomo en lugar del peso atómico.
La modificación que introdujo Moseley se debe a que el número de protones en el núcleo del átomo es determinante en la identidad química de cada elemento. A diferencia del número de protones, un átomo puede tener diferente número de electrones (por ejemplo, Na+ y Na0) o neutrones (por ejemplo, 32S o 34S); incluso isótopos de elementos químicos diferentes pueden tener la misma masa atómica, por ejemplo, el 14C (6 protones + 8 neutrones) y 14N (7 protones + 7 neutrones) tienen la misma masa atómica. Sin embargo, el número de protones en el núcleo de un átomo de un mismo elemento químico siempre es constante.
Actualmente, la tabla periódica ordena los 118 elementos químicos conocidos con base en su número atómico en 18 grupos (columnas) y 7 periodos (filas). Con este orden también es posible distinguir propiedades periódicas. Por ejemplo:
- El grupo 18 comprende a los gases nobles, los cuales se distinguen por una muy baja reactividad química dado que tienen la capa de valencia completa.
- Los elementos del grupo 1 poseen un electrón en su capa de valencia y lo pierden fácilmente.
- El patrón general es que el volumen atómico es mayor conforme aumenta el número de periodo, y es menor conforme aumenta el número de grupo, mientras que la electronegatividad es mayor a medida que aumenta el número de grupo y es menor conforme aumenta el número del periodo.
La lista de propiedades periódicas podría extenderse a afinidad electrónica, potencial de ionización, radio atómico, carácter metálico, reactividad, valencia, estructura atómica… Pero, aquí terminamos con los ejemplos de las propiedades periódicas porque nos llevaría al menos un semestre estudiarlas con detalle.
Para concluir, la tabla periódica nos brinda una gran cantidad de información sobre los elementos químicos, lo que nos puede facilitar la predicción de reacciones químicas en general y, en particular, las que ocurren en un organismo vivo o entre elementos inorgánicos y macromoléculas biológicas, entre muchas otras aplicaciones. Lo único que necesitas para obtener toda esta información es mirar la tabla y recordar un poco las generalidades de las propiedades periódicas.
¿Quieres saber más?
Wisniak, J. (2005), «Stanislao Cannizzaro«, Educación Química, UNAM,16 (3): 456-468.




Que interesante Luciferasa, me recordó el edificio de la facultad de Química (UNAM) con la tabla periódica.