En una entrada anterior, les escribí sobre las maravillas y rarezas de la química en entornos de altísimas presiones, como en el núcleo de los planetas. Más allá de lo teórico y experimental, ¿tiene esto alguna aplicación práctica en nuestra vida cotidiana? Antes de responder esto, es mejor detenerse a entender por qué suceden las reacciones químicas.
Veamos un ejemplo, para formar la molécula más simple de todas, el H2, es necesario que dos átomos de hidrógeno estén lo suficientemente cerca como para que la interacción entre los electrones y los núcleos lleve al sistema a un estado de mínima energía (Figura 1), que es un principio fundamental de la naturaleza guiado por la Segunda Ley de la Termodinámica. Cuando dos moléculas reaccionan para formar un nuevo compuesto, buscan principalmente llegar a un estado de menor energía.
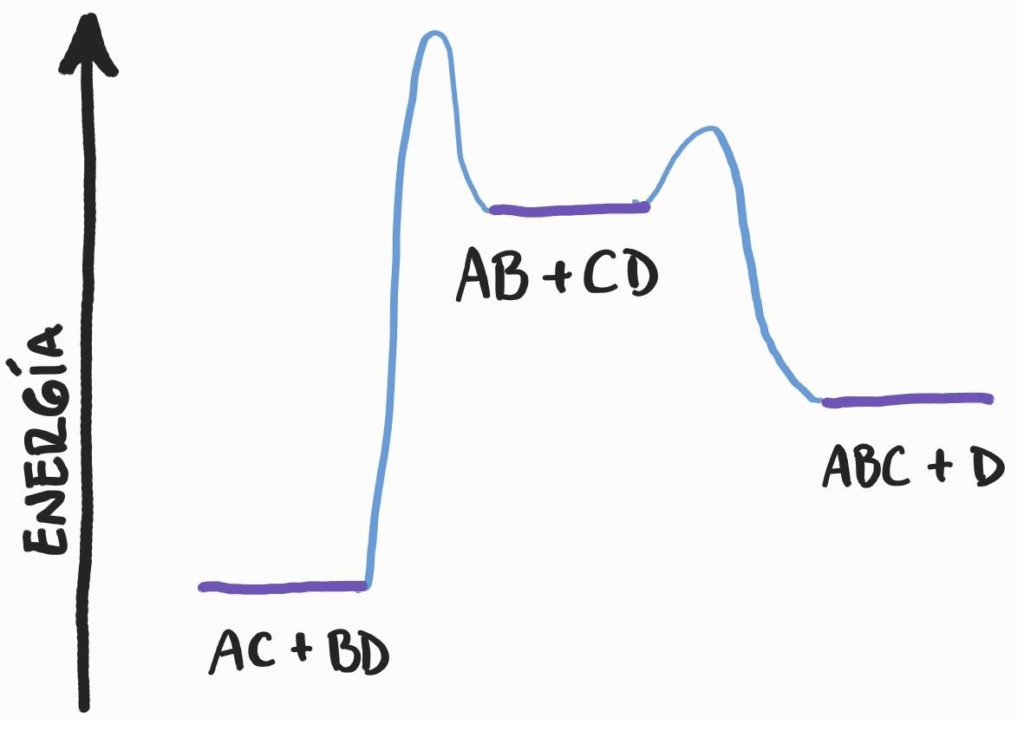
Figura 1. Reacción química que puede formar dos productos distintos. El de menor barrera se forma más rápido, pero el otro es más estable. Imagen por Roble Cuántico.
Muchas veces, las reacciones químicas requieren de una “chispa” que active las moléculas y les sea más fácil llegar a los productos. En otras palabras, los reactantes deben sobrepasar una barrera de energía antes de llegar a su forma final. Un “peaje energético”, por así decirlo. Puede ocurrir que algunos caminos tengan peajes más baratos que otros, pero llevan a productos que no son los óptimos energéticamente, no son los más estables.
El ejemplo por excelencia son las formas alotrópicas del carbono (Figura 2). En condiciones estándar de temperatura y presión, la forma más estable del carbono es el grafito. Sin embargo, aún en las mismas condiciones se puede observar otra forma de carbono: el diamante, cuya estructura cristalina es distinta. El diamante se puede formar a altísimas presiones, pero una vez formado puede mantenerse en esa forma aún en condiciones estándar debido a que el coste energético para volverse grafito es muy alto, por lo que esa transición es muy lenta para ser observada.

Figura 2. Estructura cristalina del diamante (izquierda) y el grafito (derecha).
Esta misma idea puede ser aplicada en la creación de nuevos materiales con propiedades exóticas. Para ilustrar un caso, se sabe que el dióxido de carbono, un gas de efecto invernadero, forma un sólido con una estructura similar a la del óxido de silicio a presiones y temperaturas altas. ¿Te imaginas que para una cierta combinación de estas variables se pueda crear un material de CO2 estable en condiciones normales? Esto sería una excelente noticia para la investigación enfocada en el cambio climático.
Aún así, no es necesario especular tanto para encontrar más ejemplos. Muchos de los compuestos químicos que se fabrican industrialmente y son importantes en nuestra sociedad se sintetizan utilizando condiciones específicas de temperatura y presión. El amoniaco se produce industrialmente a partir de hidrógeno y nitrógeno a altas presiones y cerca de los 400°C, la temperatura más baja posible para que esta reacción sea económicamente viable. En otras condiciones, sería extremadamente lenta o ineficiente.
Como la química a presión atmosférica ha sido ampliamente estudiada, ahora la investigación se ha estado expandiendo hacia un nuevo límite que permite explorar una nueva área con compuestos químicos y materiales inusuales. El proceso de Haber-Bosch para la producción de amoniaco puede considerarse como uno de los pioneros del siglo pasado, por lo que puede que no falte mucho para que haya una nueva revolución en la creación de nuevos materiales que permitan solucionar los problemas actuales de la sociedad.
¿Quieres saber más?
Kinetic vs. Thermodynamic Control of Reactions
Grochala, W., et al. (2007), “The Chemical Imagination at Work in Very Tight Places”, Angewandte Chemie International Edition, 46 (20): 3620-3642.
Appl, M. (1982), “The Haber-Bosch Process and the Development of Chemical Engineering”. A Century of Chemical Engineering. Plenum Press, pp. 20-54.



